Klicka för större bild.
Vad är biosimilarer?
Inom EU används ordet biosimilarer om kopior av biologiska läkemedel, som vaccin, enzymer och antikroppar. ”Kopior” borde man egentligen skriva, eftersom en biosimilar aldrig är helt identisk med originalet.
Varför är den inte identisk?
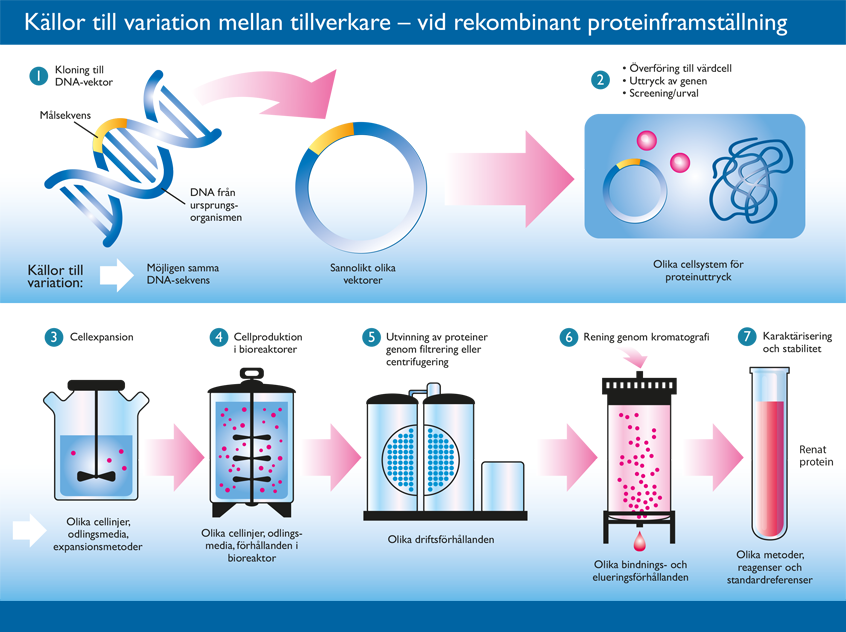
Biologiska läkemedel består av stora och komplexa molekyler som är svåra att kopiera exakt. Dessutom är tillverkningsprocessen i sig så komplicerad, så det är nästan omöjligt att få samma resultat varje gång. I biologiska läkemedel har den aktiva substansen tillverkats i, eller renats fram ur, ett levande material. Substansen kan till exempel vara ett protein. För att producera det tar man den DNA-sekvens som kodar för proteinet och för in den i exempelvis en jästcell. Cellen börjar då tillverka proteinet. På det här viset förvandlas jästceller till små medicinfabriker, och cellerna kan fermenteras (växa och dela sig) tills man har tillräckliga mängder substans. Därefter utvinns och renas substansen fram i flera steg. På grund av den komplicerade processen och de många stegen kan olika produktionsomgångar, batchar, av ett läkemedel skilja sig lite åt – och biosimilaren kan skilja sig något från originalet.Men biosimilarer är alltså samma sak som generika?
På sätt och vis. Precis som generika, alltså kopior av kemiska läkemedel, så kan biosimilarer tillverkas när patenttiden för originalläkemedlet löpt ut. Både biosimilarer och generika skapar konkurrens mellan läkemedelsföretag, vilket pressar priserna och minskar kostnaderna i vården. Men prissänkningarna vid användning av biosimilarer är hittills inte lika kraftiga som vid generisk konkurrens. Generika har ibland fått läkemedelspriser att sjunka med 95 procent. För biosimilarer har det hittills handlat om mellan 15 och 35 procent – men det finns undantag, där skillnaden är betydligt större.Finns det andra skillnader jämfört med generika?
Ja. Processen fram till ett godkännande skiljer sig en hel del. För att en biosimilar ska godkännas krävs omfattande studier, både kliniska och prekliniska. Där måste tillverkaren visa att de biokemiska egenskaperna, effekten och säkerheten motsvarar originalets. För generika krävs noggrann dokumentation, men oftast inte kliniska studier. En annan skillnad är att svenska apotek inte får byta ut ett biologiskt läkemedel mot en biosimilar. Det är bara den förskrivande läkaren som får göra det. Skälet är att biosimilarer inte är identiska med originalen, de har inte funnits lika länge som generika, och Läkemedelsverket bedömer att det saknas tillräcklig erfarenheten av preparaten för att man ska kunna byta på apotek. Först krävs mer uppföljning och dokumentation. Det är möjligt att vissa substanser i framtiden kommer att kunna bytas, medan andra inte gör det.Hur många biosimilarer finns det?
Från 2006 och fram till nu har drygt 20 biosimilarer godkänts för användning inom EU. Den europeiska läkemedelsmyndigheten EMA sköter godkännandeprocessen utifrån ett särskilt regelverk. I resten av världen gäller andra regler för biologiska kopior. Under det första halvåret 2015 gick patentskyddet i Sverige ut för två stora biologiska läkemedel som har godkända biosimilarer på marknaden; TNF-α-hämmaren Remicade och diabetesmedicinen Lantus. Förra året stod de två läkemedlen för sjukvårdskostnader på sammanlagt över 800 miljoner kronor. Ersättaren för Remicade används sedan tidigare i Norge och under våren rapporterades den ha sänkt kostnaden med nästan 70 procent och tagit halva marknaden. Det återstår att se om effekten blir lika stor i Sverige.Några utmaningar med biosimilarer?
För att man ska kunna utvärdera biologiska läkemedel och biosimilarer måste det vara möjligt att studera effekt och säkerhet mycket noga under användningen. Eftersom biologiska läkemedel kan skilja sig sinsemellan beroende på när de producerats, så måste varje enskild batch kunna spåras. Det måste också gå att spåra medicinanvändningen för enskilda patienter i slutenvården, vilket ställer höga krav på vårdpersonalen. Sedan 2012 har EMA krävt att både läkemedelsnamn och batchnummer ska skrivas in i patientjournalen när biologiska läkemedel används, men fortfarande görs det långtifrån alltid. Dock meddelade Svensk reumatologis kvalitetsregister nyligen att svenska läkare det senaste året har blivit betydligt bättre på att ange batchnummer i biverkningsrapporter för biologiska läkemedel. Läkemedelsverket har på EU-nivå väckt frågan om att utveckla ett verktyg för att göra det lättare att möta EMA:s krav. Än så länge har detta inte fått något resultat. En annan utmaning är om biosimilarer ska godkännas för bara de indikationer som de testats kliniskt för, eller om det räcker att testa för bara någon av originalpreparatets indikationer men ändå få godkänt för alla. EMA gör på det senare viset, vilket kallas att man extrapolerar indikationer. Likadant gör man i USA, medan det kanadensiska läkemedelsverket har gjort tvärtom – de kräver kliniska studier för varje indikation.Några röster om biosimilarer
”… måste det vara upp till den behandlande läkaren vad patienten ska få förskrivet, inte en upphandlingsenhet. Detta gäller i synnerhet för biosimilarer som inte är identiska, och därmed inte utbytbara. I dag är det oklart var makten över valet av biopreparat kommer att ligga; hos patienten, förskrivaren, apoteken eller inköpsavdelningarna.” Håkan Mellstedt, professor Cancer Centrum Karolinska, i debattartikel i Läkartidningen maj 2014 ”Läkemedelsverket bör utarbeta informationsmaterial… för att möta det informationsbehov som finns hos vårdgivare, upphandlare och patienter.” LIF, LIFe-time.se ”Inga switchar [byte mellan läkemedel och kopia] bör ske utan patienters vetskap.” Diana Skingle, ordförande för PARE – People with Arthritis/Reumatism in Europe (del av EULAR), juni 2015
Mer information om biosimilarer finns här.

